
 更新時間:2025-12-31
更新時間:2025-12-31 點擊次數:82
點擊次數:82
在糖尿病傷口治療領域,傳統敷料如紗布、繃帶等功能單一,難以應對糖尿病傷口復雜的病理微環境。高血糖狀態易導致傷口持續感染、炎癥反應失衡、氧化應激加劇及血管生成受阻,這些因素相互交織,形成惡性循環,嚴重阻礙愈合進程。今天分享的文獻提出并構建了一種基于表沒食子兒茶素沒食子酸酯(EGCG)、羧甲基殼聚糖(CMCS)和2-甲酰基苯硼酸(2-FPBA)的新型雙動態共價交聯水凝膠敷料,該水凝膠不僅具備良好的力學性能(粘附、可注射、可塑形與自愈合)、pH響應性藥物釋放和近紅外光熱特性,還具有顯著的抗菌、抗氧化、抗炎和促血管生成活性;更為突出的是,該水凝膠能夠通過噴涂天然有機酸(如檸檬酸、水楊酸和維生素C)實現按需剝離,避免更換敷料時對傷口的二次損傷,從而在糖尿病小鼠全層皮膚缺損模型中有效促進傷口愈合,相關研究成果在Chemical Engineering Journal (IF=13.2, Q1) 上以題名為On-demand detachable adhesive hydrogel based on dual dynamic covalent cross-linked with NIR/pH dual-responsive properties for diabetic wound healing發表,下面小編帶大家看一下該研究的具體內容。

該研究通過一鍋法快速構建了基于雙動態共價交聯的粘附性水凝膠,其核心是利用羧甲基殼聚糖(CMCS)的氨基與2-甲酰基苯硼酸(2-FPBA)的醛基形成希夫堿鍵,同時通過2-FPBA的硼酸基團與表沒食子兒茶素沒食子酸酯(EGCG)的酚羥基形成硼酸酯鍵,從而形成雙重動態交聯網絡;隨著EGCG含量的增加,水凝膠由淡黃色轉變為深棕色,結構更為致密,且多種表征手段(SEM、UV-vis、FT-IR、XPS、1H NMR)均證實了這兩種動態鍵的成功構建與均勻分布,為后續賦予水凝膠多重響應性與功能奠定了基礎。

作者團隊對水凝膠的力學與流變性能進行了系統表征。粘附性測試表明,水凝膠能牢固粘附于多種材料及濕態生物組織表面,其對豬皮的粘附強度隨EGCG含量增加而提升,可達17.51 kPa,顯著高于商用纖維蛋白膠。壓縮測試顯示,隨著EGCG比例增加,水凝膠能承受更高的應力(>90 kPa),這得益于動態共價鍵網絡的可逆重構能力。流變學分析進一步證實,水凝膠表現出典型的類固體彈性行為(G' > G''),且其模量和結構強度隨EGCG含量增加而增強;在交替應變循環測試中,水凝膠展現出優異的自愈合性能,其網絡結構能在破壞后迅速恢復,這為材料在傷口處的長期穩定貼合和通過注射進行微創填充應用提供了關鍵保障。

后續作者重點驗證了水凝膠的光熱性能及其對抗菌活性的增強作用。結果顯示,由于EGCG帶來的深棕色澤賦予了材料顯著的光熱轉換能力,水凝膠在808 nm近紅外光照射下能快速升溫,且升溫幅度隨EGCG含量及激光功率密度的增加而提高,并表現出良好的循環穩定性;同時,光熱效應能加速EGCG從水凝膠中的釋放。在抗菌方面,水凝膠本身對革蘭氏陽性菌(如金黃色葡萄球菌、MRSA)和革蘭氏陰性菌(如大腸桿菌、沙門氏菌)均表現出明顯的抑制效果,且抗菌活性隨EGCG含量增加而增強;更重要的是,結合近紅外光照射后,其抗菌效果得到極大提升,幾乎能殺滅測試菌種,掃描電鏡觀察也證實經“水凝膠+NIR"處理的細菌形態發生嚴重損毀。這表明該水凝膠兼具內在的抗菌能力與外部光熱協同殺菌功能,能有效應對糖尿病傷口易感染的難題。
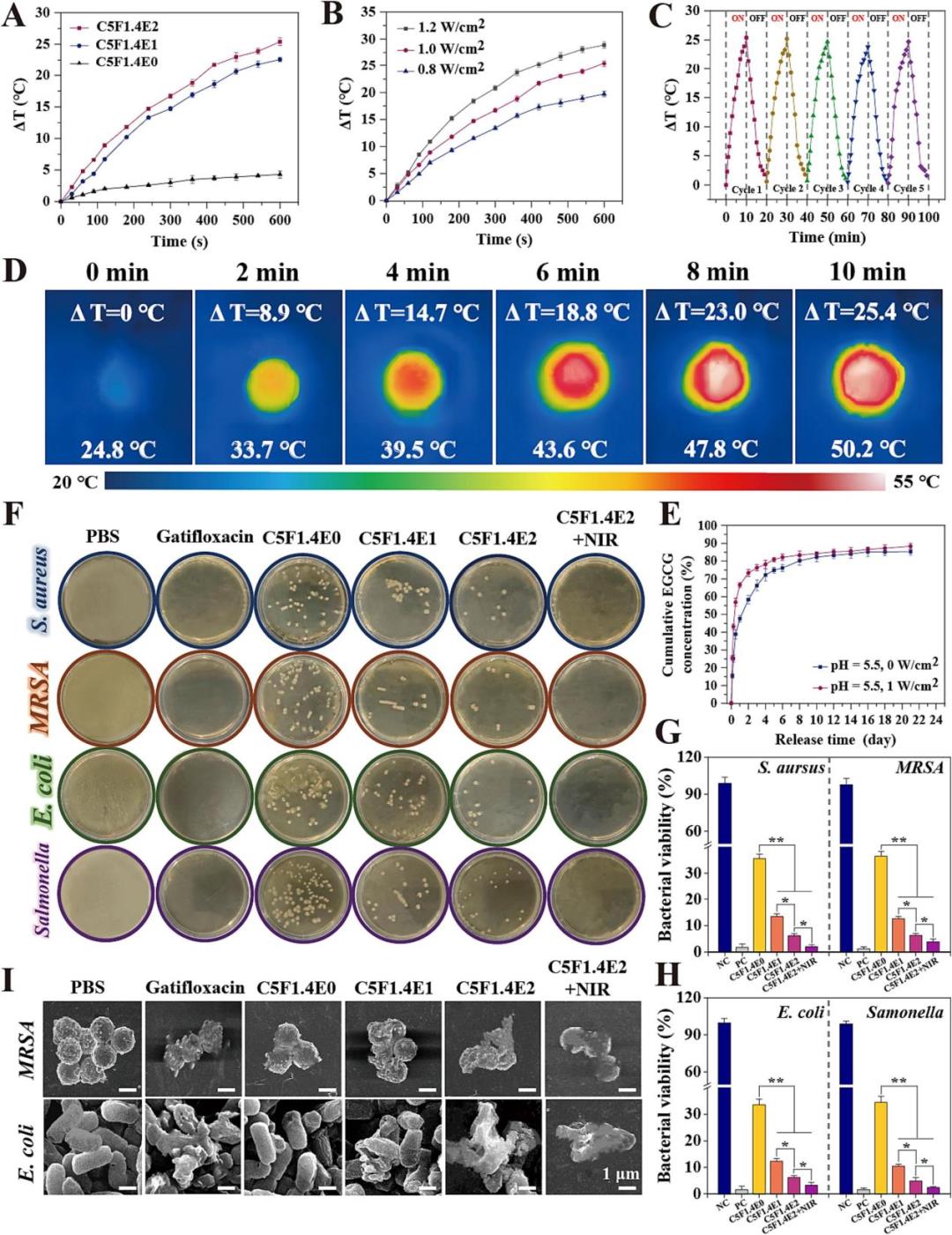
接下來作者系統評估了水凝膠的體外抗氧化能力。通過DPPH和PTIO自由基清除實驗發現,水凝膠的自由基清除率隨EGCG含量增加而顯著提升,其中CSF1.4E2水凝膠對兩者的清除率分別高達95.1%和90.2%,這主要歸因于EGCG分子中密集的酚羥基所賦予的強大還原能力。在細胞層面,使用DCFH-DA探針檢測NIH-3T3細胞內活性氧(ROS)水平的結果表明,與水凝膠提取物共培養后,由Rosup或H?O?誘導產生的過量ROS被有效清除,熒光強度隨EGCG含量增加而快速減弱;流式細胞術定量分析進一步證實,CSF1.4E2處理組細胞的ROS陽性率較低(僅4.97%)。這些結果共同證明了該水凝膠能有效緩解氧化應激,為改善糖尿病傷口中因高糖和感染導致的ROS過度累積的病理微環境提供了關鍵功能。
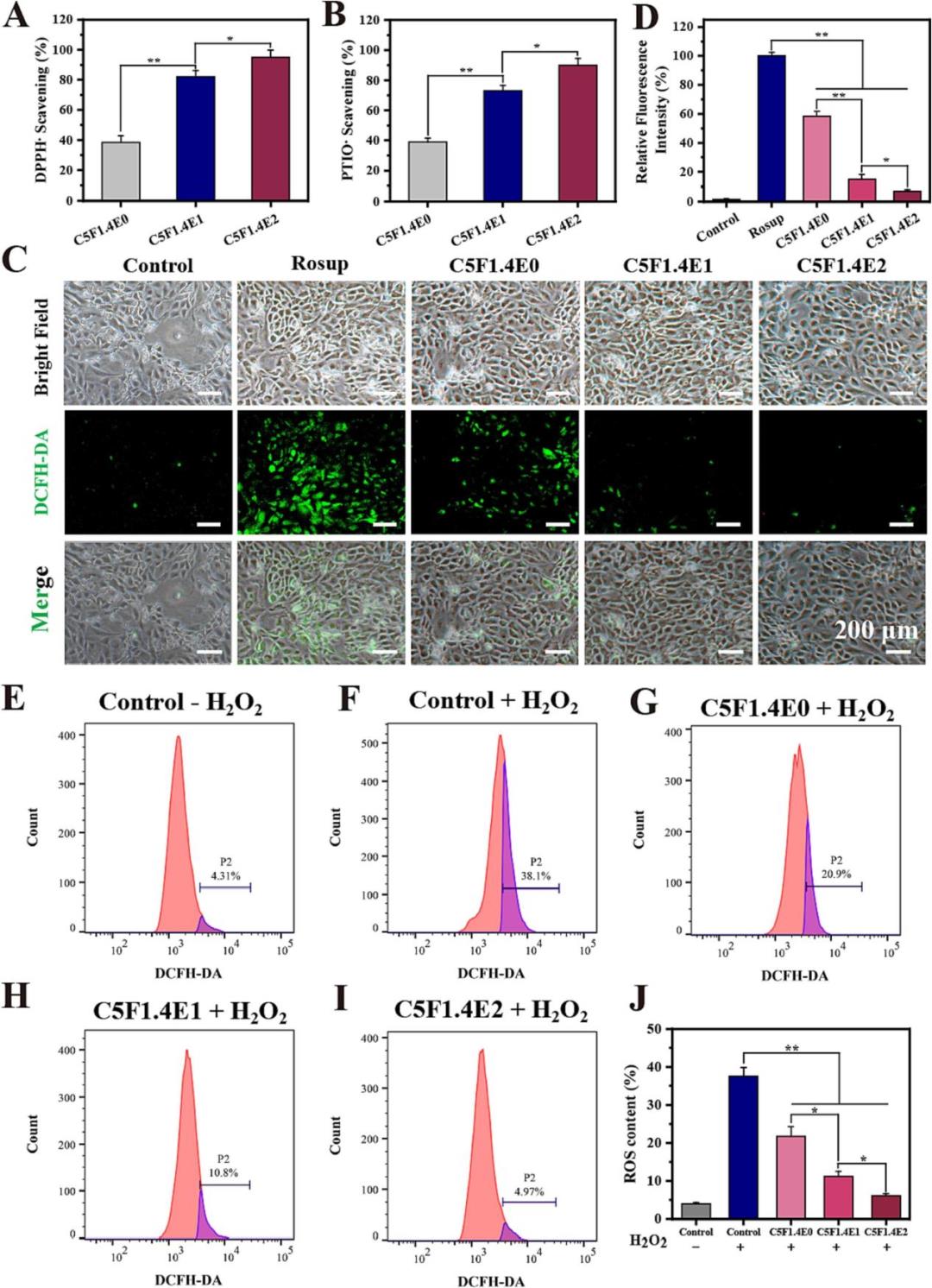
而后作者繼續深入評估了水凝膠的體外抗炎活性。在脂多糖(LPS)和干擾素-γ(IFN-γ)刺激的RAW 264.7巨噬細胞炎癥模型中,水凝膠能有效抑制關鍵促炎因子TNF-α和IL-1β的表達,且抑制效果隨EGCG含量增加而增強。更重要的是,通過流式細胞術與免疫熒光染色分析巨噬細胞表型發現,水凝膠處理能顯著降低促炎的M1型巨噬細胞(CD86+標志)比例,同時提高抗炎、促修復的M2型巨噬細胞(CD206+標志)比例,表明其能有效調控巨噬細胞從促炎表型向促愈合表型極化。這些結果共同證明,該水凝膠不僅能直接抑制炎癥介質釋放,還能通過調節免疫細胞功能來逆轉糖尿病傷口中常見的持續性炎癥狀態,為創建有利于組織再生的微環境提供了關鍵機制。
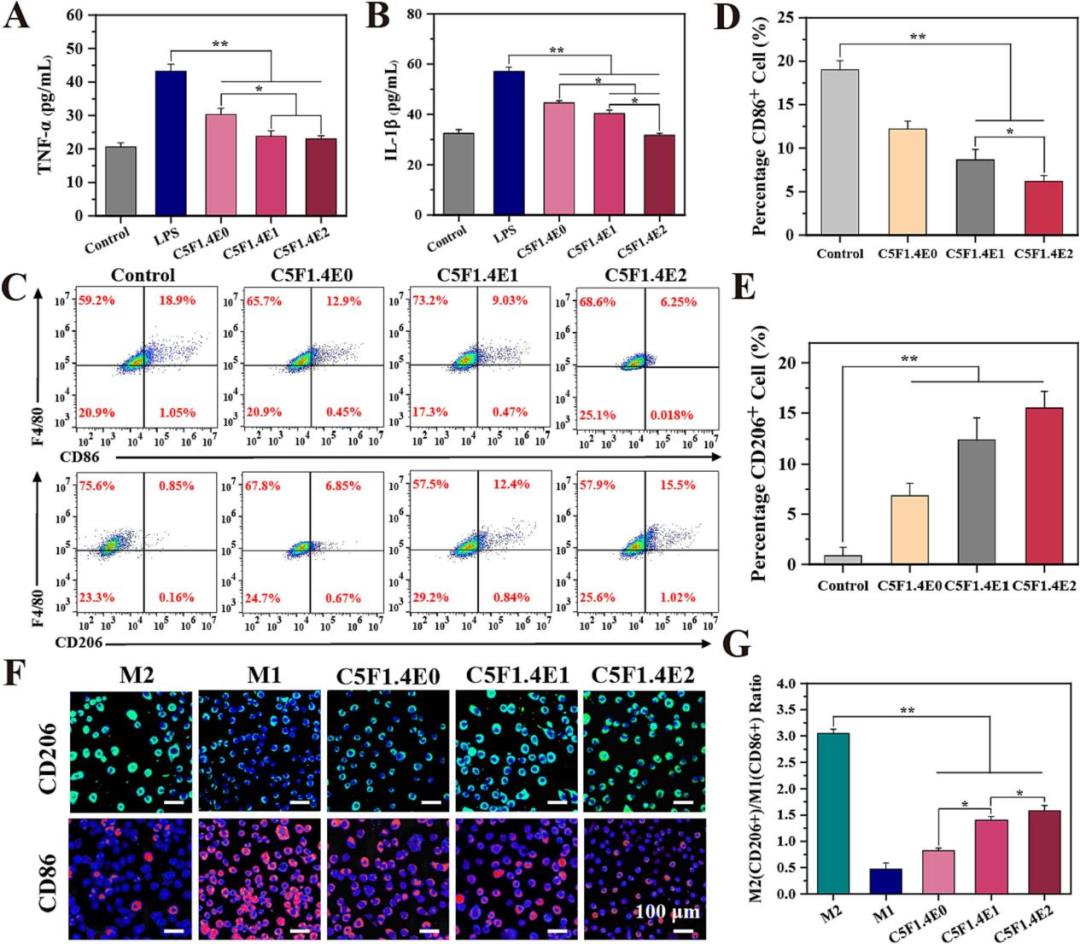
水凝膠的生物相容性及促血管生成
該研究系統評估了水凝膠的體外細胞相容性及其對細胞增殖、遷移和血管形成的促進作用。細胞活性與增殖實驗表明,水凝膠提取物對NIH-3T3、RAW 264.7和HUVECs等多種細胞均顯示出良好的生物相容性,并能顯著促進細胞增殖,該效應隨EGCG含量增加而增強,且近紅外照射可進一步放大此效果。劃痕與Transwell遷移實驗證實,水凝膠能有效加速NIH-3T3和HUVECs的遷移過程,且遷移能力與EGCG含量呈正相關。尤為重要的是,體外血管形成實驗清晰顯示,CSF1.4E2水凝膠(特別是聯合NIR組)能顯著誘導人臍靜脈內皮細胞形成更復雜、更長的管狀網絡結構。這些結果綜合表明,該水凝膠不僅具備優異的生物安全性,更能通過直接刺激細胞增殖、遷移及促血管生成等關鍵環節,為加速糖尿病傷口愈合的細胞學基礎提供了有力證據。
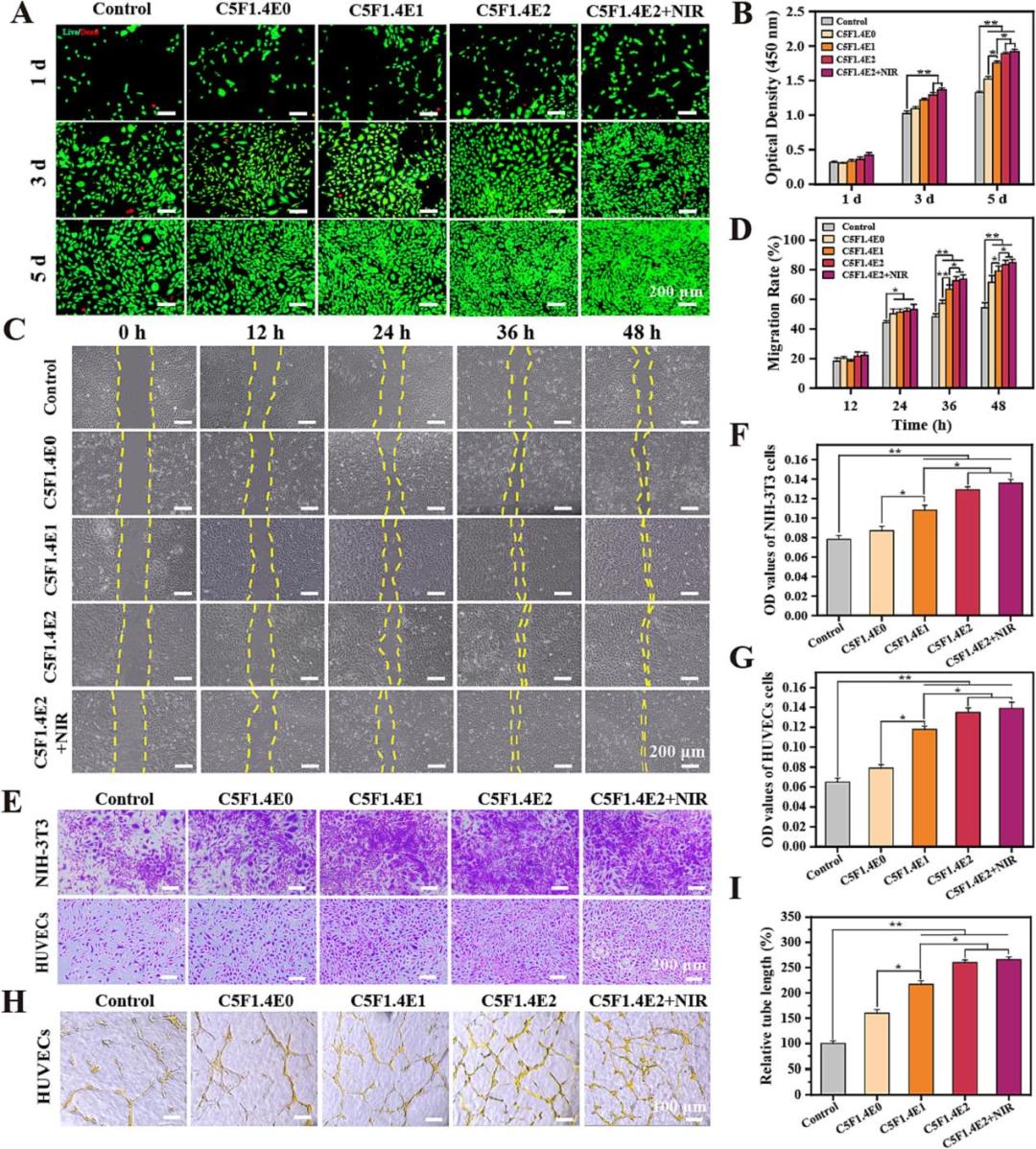
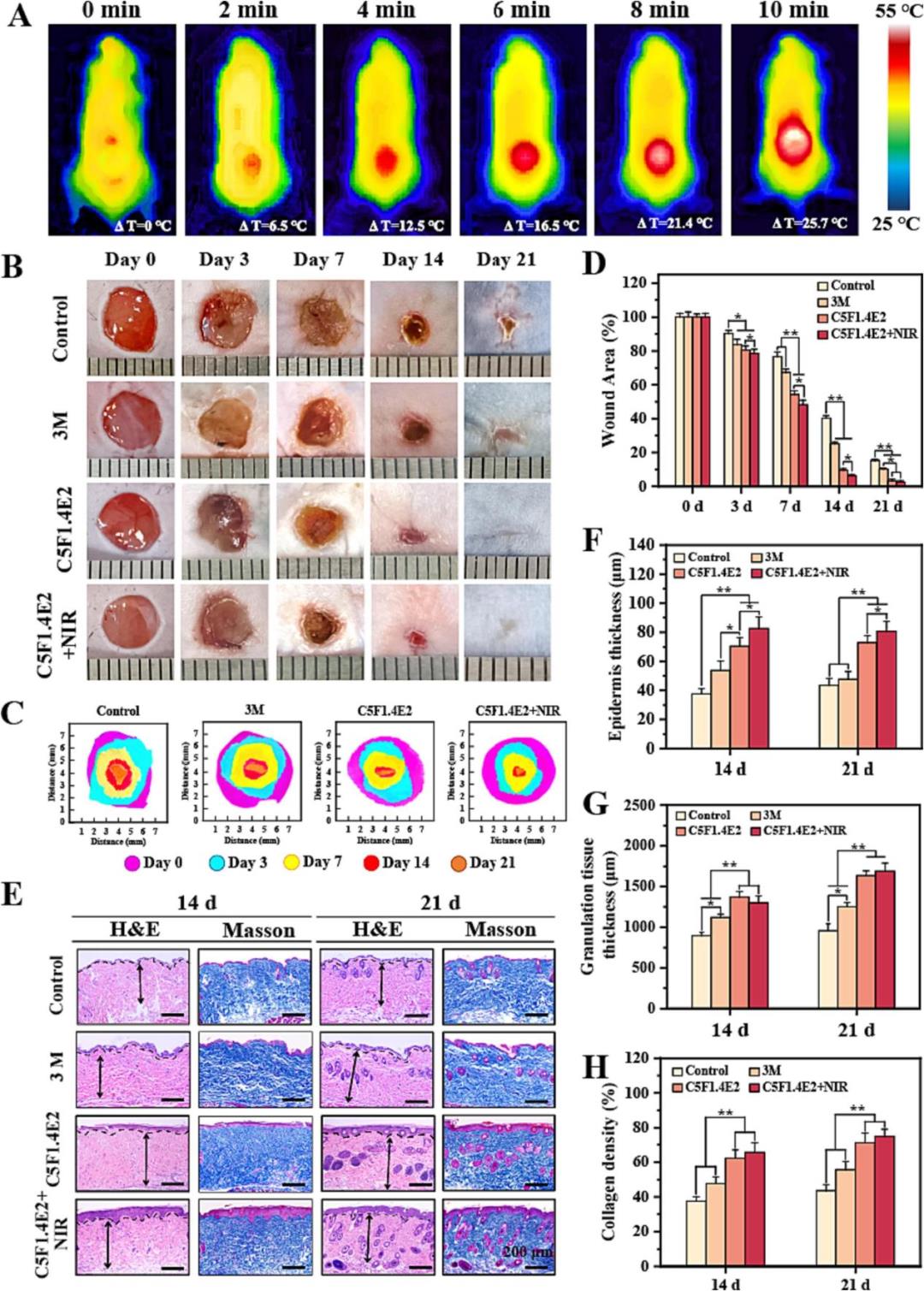
該研究通過建立糖尿病小鼠全層皮膚缺損模型,在體內驗證了水凝膠對傷口愈合的顯著促進作用。結果顯示,負載水凝膠的傷口在近紅外光照射下能實現精準、快速的局部升溫。宏觀觀察與傷口面積定量分析表明,經CSF1.4E2水凝膠(尤其是聯合NIR照射組)處理的傷口,其愈合速度明顯快于對照組和商用敷料組,至第14天時傷口閉合率已超過90%。組織學分析(H&E和Masson染色)進一步揭示,水凝膠治療能促進更完整的上皮再生、形成更厚的肉芽組織,并誘導更豐富、更致密的膠原沉積。這些結果從整體療效到微觀結構層面,共同證實了該水凝膠敷料能有效加速糖尿病傷口修復的關鍵進程,包括再上皮化、肉芽組織形成和細胞外基質重塑。
水凝膠促進血管生成和抑制基質過度降解
作者團隊隨后通過免疫熒光與蛋白質印跡等手段,深入揭示了水凝膠在體內促進糖尿病傷口血管生成、細胞增殖及調控細胞外基質代謝的關鍵作用。結果顯示,經水凝膠(尤其是CSF1.4E2組)處理的傷口組織中,促血管生成因子(HIF-1α、VEGF)、血管標志物(CD31)及血管周細胞標志物(α-SMA)的表達均顯著上調,且近紅外(NIR)照射能進一步強化此效應,證明其能有效促進新生血管網絡的形成。同時,細胞增殖標志物Ki-67表達顯著增加,而凋亡標志物Caspase-3和過度降解細胞外基質的基質金屬蛋白酶MMP2的表達則被明顯抑制。這些結果共同表明,該水凝膠能協同創造一個利于組織再生的微環境:通過促進血管化保障營養與氧氣供應,通過刺激細胞增殖并抑制凋亡來加速組織修復,并通過調控MMP2表達以維持細胞外基質的穩定沉積,從而多維度協同加速糖尿病傷口的愈合進程。

最后,作者團隊通過RNA測序技術從分子層面深入闡釋了水凝膠聯合近紅外光照射促進糖尿病傷口愈合的作用機制。主成分分析(PCA)清晰地顯示了治療組(CSF1.4E2+NIR)與對照組在基因表達譜上的顯著差異。差異表達基因(DEGs)分析表明,治療組共有798個基因發生顯著變化,其中513個上調,285個下調;熱圖進一步顯示,多個與皮膚修復相關的基因(如F2、Cdh16、Igfn1)被顯著激活。通路富集分析(KEGG)揭示,治療組中細胞粘附連接、細胞因子-細胞因子受體相互作用以及白細胞跨內皮遷移等與維持皮膚完整性、促進增殖血管化和抑制炎癥密切相關的通路被顯著上調。同時,基因本體(GO)分析表明,在治療組中,涉及細胞與肌肉組織增殖、遷移、形態發生以及新基質形成等對傷口愈合至關重要的生物學過程得到顯著富集。這些組學數據從系統水平證明,該水凝膠治療策略能夠通過協同調控多條關鍵信號通路與生物學過程,從促進修復、抑制炎癥和重塑微環境等多維度共同驅動糖尿病傷口的加速愈合。
